España vuelve a liderar los ensayos clínicos en Europa, pero afronta el reto de competir en la carrera biomédica global
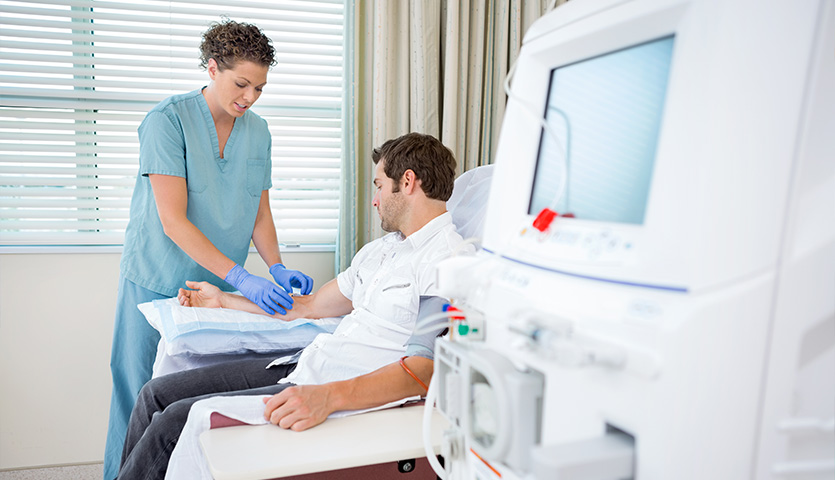
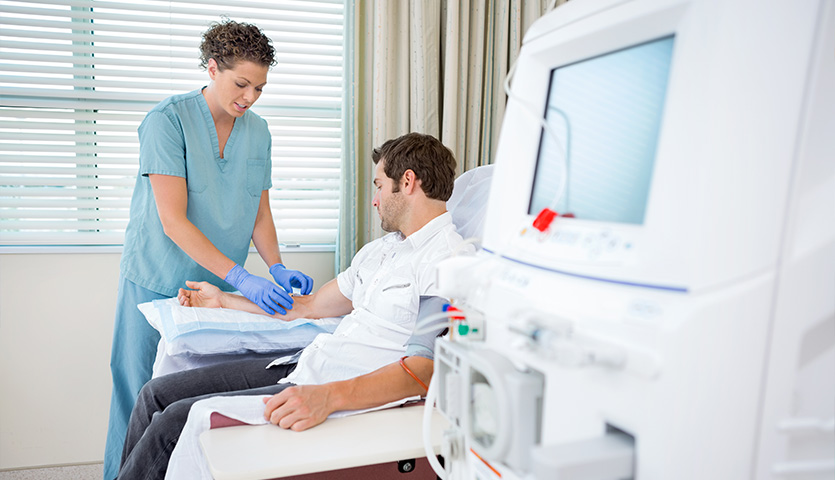
Nuestro país autorizó 962 estudios el año pasado, un centenar más que en 2023. Cuatro de cada 10 investigaciones se dedicaron a buscar nuevos fármacos contra el cáncer
España es con diferencia el país de Europa que más estudios inició en 2025 (849), seguido de Francia (732), Alemania (711) e Italia (593)
Los cambios geopolíticos están transformando el panorama mundial de innovación en salud y España y Europa deben adoptar políticas decididas si quieren seguir siendo competitivas en la carrera global por la inversión farmacéutica.
farmaindustria.es
España autorizó el año pasado 962 ensayos clínicos con medicamentos, cifra récord que sitúa a nuestro país como el líder europeo con mayor número de ensayos autorizados, así como el que lo hace en una mayor diversidad de áreas terapéuticas. Son datos que se desprenden del Registro Español de Estudios Clínicos, REEC, coordinado por la Agencia Española de Medicamentos y Productos Sanitarios (Aemps).
Esta cifra culmina además una década de crecimiento sostenido en esta etapa de la investigación, el final de una compleja, prolongada y arriesgada carrera de fondo que supone la I+D de los nuevos medicamentos, que empieza cuando investigadores identifican un compuesto prometedor, en la etapa preclínica, y culmina años después, cuando, si todo ha ido bien, el nuevo fármaco se pone a disposición de los pacientes.

farmaindustria.es
El crecimiento, sostenido desde 2016, se ha hecho especialmente patente en los últimos dos años, con más de un centenar de ensayos adicionales. Además, España es, con diferencia, el país europeo más activo en investigación clínica. Tal como reflejan los datos de la plataforma de registro de ensayos clínicos europeos (CTIS), nuestro país inició en 2025 un total 849 ensayos clínicos, muy por delante de Francia (732), Alemania (711) e Italia (593).
 Clinical Trials Information System (CTIS)
Clinical Trials Information System (CTIS)
farmaindustria.es
La búsqueda de nuevos fármacos contra el cáncer concentra cuatro de cada 10 ensayos y es el área terapéutica con mayor número de estudios. El nuestro es el país europeo con más investigaciones en esta área y varios hospitales españoles son referencia a nivel europeo. Este tipo de estudios son clave, como resalta la Aemps, porque consiguen reclutar un número suficiente de pacientes en distintos países para obtener resultados sólidos y acelerar el desarrollo de tratamientos.
Tras los tumores, las áreas con mayor número de estudios son las patologías del sistema inmunitario (10,5% de las investigaciones), las relativas al sistema nervioso (6,9%), cardiovascular (6,2%) y tracto respiratorio (4,4%). El 22,5% de los ensayos se destinaron a enfermedades raras.
Los ensayos en fase 1 representan el 25% y en fase 2% el 31%, ambas fases en crecimiento en las últimas décadas ponen de manifiesto la fortaleza de España en investigación clínica y además, el alto nivel científico de los profesionales sanitario, así como la posibilidad de ofrecer más opciones y de forma más prematura a los pacientes.
Como recuerda la Aemps, el liderazgo de España se debe a varios factores. Entre otros, a una red hospitalaria altamente capacitada con casi 1.000 centros implicados en investigación clínica en los últimos cinco años; a la participación creciente de pacientes y una de las mejores tasas de reclutamiento a nivel europeo, así como a la importante colaboración público-privada. Hay que reseñar que más del 80% de los ensayos clínicos son financiados por la industria farmacéutica.
El impulso de la investigación por parte de la industria es, por tanto, clave para que España y Europa puedan seguir ofreciendo a la sociedad los medicamentos innovadores, especialmente en un momento en que Estados Unidos y Asia están aplicando políticas comerciales agresivas para atraer la innovación a su territorio. Esto ha provocado que Europa haya perdido en las dos últimas décadas un 25% de cuota de I+D, en detrimento de EEUU y Asia.
“Tenemos el potencial para ser líderes en la investigación, desarrollo y producción de nuevos medicamentos, pero los cambios geopolíticos están transformando el panorama mundial de innovación en salud y es necesario actuar con urgencia para no perder la carrera global por la innovación. Es fundamental aprovechar estas fortalezas y adoptar medidas políticas decididas para que Europa pueda seguir siendo competitiva en la carrera global por la inversión farmacéutica”, subraya Juan Yermo, director general de Farmaindustria.
Hacer esto realidad exige que Europa consolide y amplíe la senda recientemente iniciada para agilizar y simplificar los procesos de autorización de los ensayos clínicos, en coherencia con iniciativas como el Fast EU y la futura Biotech Act, necesarios para reforzar la competitividad europea, atraer inversiones y sobre todo facilitar que los pacientes europeos accedan a los tratamientos en desarrollo lo más rápido posible.
Atención primaria y evaluación acelerada
En el último año, Farmaindustria ha continuado impulsando nuevos proyectos para ampliar el alcance de la investigación clínica. Uno de los que tiene más fuerza es el que busca extender la investigación a los centros de salud y que este año ha dado un paso más con el establecimiento de los nuevos Mapa y Observatorio Autonómicos de Investigación Clínica en Atención Primaria.
La Asociación también ha trabajado por el impulso de los procedimientos de evaluación acelerada de los ensayos de fase I, en un principio destinados a terapias avanzadas y enfermedades raras y luego ampliados a medicamentos biológicos oncológicos.





